高密度表面肌电(HD-sEMG)在运动神经元病的应用及临床分类
前言
运动神经元病(motor neuron disease,MND)是一类主要累及大脑皮质、脑干、锥体束以及脊髓前角运动神经元的慢性进行性神经系统变性疾病。除了肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)、进行性肌萎缩(progressive muscular atrophy,PMA)、进行性延髓麻痹(progressive bulbar palsy,PBP)和原发性侧索硬化(primary lateral sclerosis,PLS)4种主要的临床类型外,还包括连枷臂/腿综合征等相对少见的特殊类型。
MND一直以来由于病例较为罕见,临床表现复杂以及缺乏生物标志物等特点,识别相对困难。本文照起病部位和临床表现对MND的临床分型(典型与非典型)简要概述如下:
一、MND临床分型:按照起病部位和临床表现分类
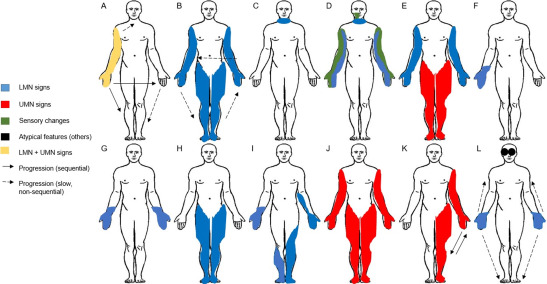
(图1)
A. 肢体起病型ALS(Spinal-onset ALS):上肢或下肢首先出现上、下运动神经元受累体征,此型占患者总数的70%。通常最先出现非对称性的上肢远端肌无力,可自一侧手部肌肉开始,数月后可波及对侧,逐渐出现手部小肌肉萎缩。随着疾病进展,吞咽困难和呼吸衰竭是最为致命的临床表现。
B. 进行性肌萎缩(progressive muscular atrophy,PMA):临床特征为进行性的LMN变性表现,包括肌肉无力、萎缩,肌束颤动,腱反射减弱或消失等,无UMN受累。一般无感觉和括约肌功能障碍。本型进展较慢,病程可达10年以上或更长。
C. 延髓起病型ALS(bulbar-onset ALS/Progressive Bulbar Palsy,PBP):PBP是一种起病迅速的MND,被认为是ALS的延髓变异型,以言语不清和吞咽困难为首要表现,随后出现肢体受累症状,此型占患者总数的25%。
D. 面部起病的感觉运动神经元病(Facial onset sensory motor neuronopathy,FOSMN):2006年由Vucic等首先报道并命名,是一种罕见、散发的MND特殊变异型。以三叉神经支配区域的感觉障碍起病,继而出现下运动神经元损害,出现肌肉萎缩、肌束颤动。
E. 连枷臂综合征(flail arm syndrome,FAS):是ALS的良性临床变异型,占运动神经元病的5%~10%,主要表现为緩慢进展的双上肢近端为主的肌无力及萎縮,以双侧不对称起病多见,症状局限在双上肢时间长,早期球部及双下肢不受累或轻度受累。
F. 平山病(Hirayama disease,HD):又称青年上肢远端肌萎症,一种少见的良性自限性下运动神经元疾病,主要累及手和前臂,出现进行性加重的肌无力及肌萎缩,并有“寒冷麻痹”现象。
G. O’Sullivan-McLeod综合征(O’Sullivan-McLeod syndrome):又称为“慢性远端脊髓性肌萎缩症”,临床特征是以缓慢进行性的手部肌肉无力和萎缩为主,可延伸至前臂,无感觉障碍或锥体束征。
H. 连枷腿综合征(Flail leg syndrome,FLS):约占ALS的2~12.9%,典型表现为非对称性的双下肢无力和萎缩,远端重下近端,查体可发现双下肢踝反射消失,病情进展缓慢后期可出现上运动神经元受累表现。
I. 假性多神经炎型ALS(Pseudopolyneuritic ALS):以相对对称性远端肌无力、肌萎缩的FLS又称假性多神经炎型ALS、Patrikios变异型或腓肌型ALS,容易被误诊为周围神经疾病。
J. 原发性侧索硬化(primary lateral sclerosis,PLS):PLS是一种以UMN变性为特征的疾病,伴有LMN的相对保留,此型较为少见,占MND的1%~4%。表现为40岁以后起病,纯PLS的最常见临床症状是肌肉痉挛、构音障碍或强哭强笑。临床体检可发现UMN受损体征,包括肌张力升高、肢体痉挛性瘫痪、腱反射亢进、病理征阳性等,并缺乏LMN受损的体征。至少3年的孤立性UMN症状不伴有明显的消瘦和萎缩更加提示PLS。
K. Mills综合征(Mills syndrome):是一种以偏侧上运动神经元损害为突出特点的罕见运动神经元病类型,临床及电生理检查无下运动神经元及感觉纤维受损。目前研究倾向于可能是PLS的一种特殊变异型。
L. 指伸肌无力伴下跳性眼震型MND(Finger extensor weakness with downbeat nystagmus–motor neuron disease,FEWDON-MND):是最近被报道的一种ALS变异型,起始于手臂远端的伸肌的无力和萎缩与经典型ALS相比进展要缓慢的多,特征性眼部表现是下跳性眼震。
二、经典型ALS特征性肌萎缩表现:
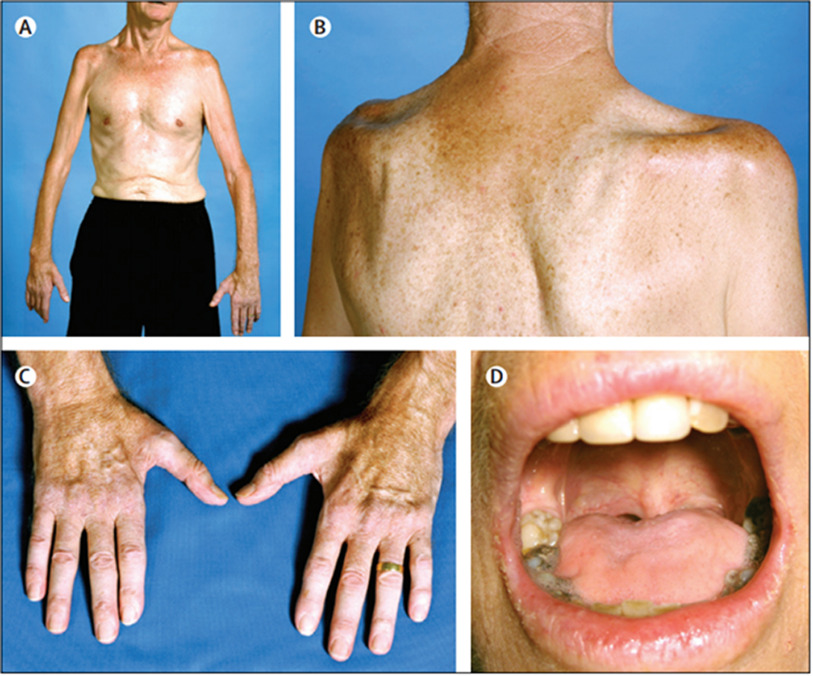
(图2)
A、对称性上肢近端肌萎缩导致手臂上抬受限(如桶人综合征或连枷臂综合征)。
B、肩胛骨上下方因冈上肌、冈下肌、三角肌萎缩出现的“凹陷”,易发生肱盂关节半脱位。
C、“分裂手”是ALS早期高特异性的临床特征,表现为大鱼际肌肌群包括拇短展肌和第一骨间肌萎缩。
D、累及延髓可见舌肌萎缩。
运动神经元病累及不同部位的临床表现
三、运动神经元病的非典型表现
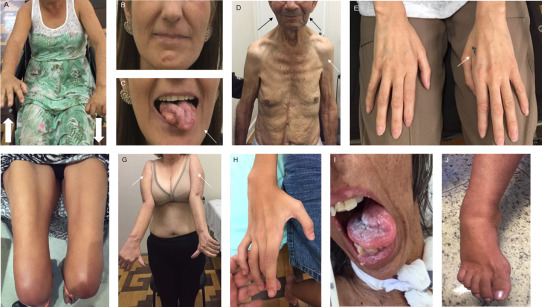
(图3)
第一行由左至右,分别为:
A. Mills综合征患者,左侧肢体无力。
B and C. FOSMN综合征患者,左侧面部肌肉萎缩,舌肌萎缩。
D. FOSMN综合征患者,双侧面部肌萎缩(黑箭)和上肢近端肌萎缩(白箭)。
E. O’Sullivan-McLeod综合征患者,左手肌萎缩。
第二行由左至右,分别为:
F. 连枷腿综合征患者。
G. 连枷臂综合征患者。
H. 平山病患者,右上肢远端肌萎缩。
I. 进行性延髓麻痹患者,舌肌萎缩、肌束颤动。
J. ALS2基因相关的青少年型ALS,UMN损害为主伴下肢肌张力障碍。
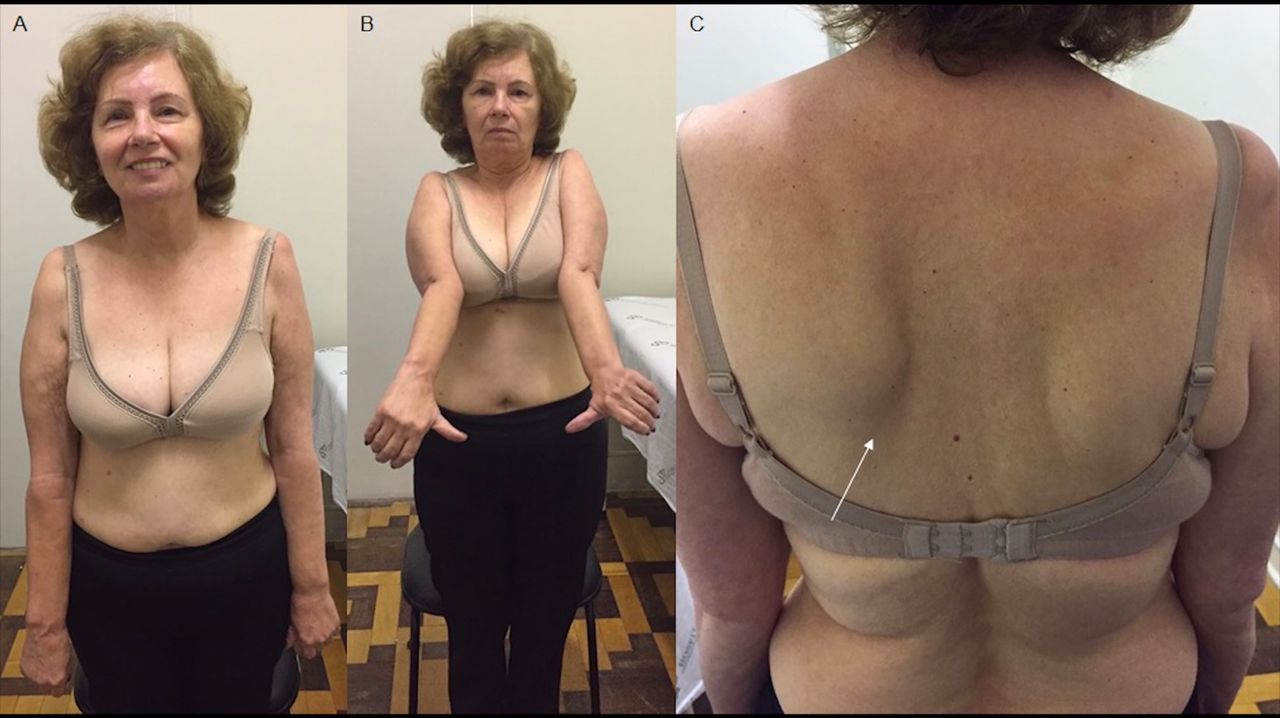
(图4)
上图为FEWDON-MND患者图B可见手和前臂伸肌肌群肌萎缩,图C示轻度翼状肩胛。
高密度表面肌电(HD-sEMG)可以在肌萎缩侧索硬化症(ALS)带来什么?
导读

文章节选:临床神经生理学 第131卷,第四期,2020年4月,第942-950页
“渐冻症“是“肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)的俗称,罹患该症的患者也被称为“渐冻症状”,这是一种神经系统疾病。支配肌肉运动的神经元慢慢变性、死亡,肌肉随之一点点萎缩,患者逐渐出现并加重肌无力、肌萎缩、吞咽困难、喝水呛咳以及说话不清等症状,逐渐失去运动能力和生活自理能力,直至死亡。“渐冻症冶患者常常只能生存几年。
英国理论物理学家史霍金在21 岁时被诊断出“渐冻症冶,医生认为他只能活两年,而他坚韧地同病魔抗争了半个世纪。他的传奇让更多的人了解到这一原因不明的罕见病,他的光辉展现了生命的顽强,给所有“渐冻人冶带来鼓舞和希望。
ALS是一种少见病,其发病率与患病率因年龄、性别、种族和地域而不同。目前,国内尚无准确的ALS发病率的流行病学报道。在美国及欧洲相关国家的ALS发病率为1~2人/10万人年,患病率为3~5人/10万人年。MARIN 等一项有关世界范围内ALS流行病学调查的Meta 分析显示,ALS发病率为1.75人(1.55~1.96)/10万人年,男性发病率比女性稍高,为2.03人(1.79~2.37)/10万人年,女性为1.45人(1.25~1.64)/10万人年,LOGROSCINO等报道本病起病年龄为46.2~66岁,散发性ALS(sporadic ALS, SALS)发病高峰年龄为58~63岁,家族性ALS(familial ALS, FALS)发病高发年龄为47~52岁。国内 LIU 等对中国10个ALS中心455 个散发性ALS 的研究结果显示,中国ALS发病年龄早于发达国家,中位发病年龄为52岁,散发性ALS男性高发年龄为55~59岁,女性为45~49岁,男性发病比女性多,大约为1.6∶1。
目前,在肌萎缩性侧索硬化症的电诊断中,常规使用侵入式针电极(NEMG)。同心圆针电极可以评估运动单元动作电位(MUAP)的持续时间和幅度,束颤电位(fasciculationpotentials,FP)持续时间,FP间间隔,转数和相数,肌内传导阻滞的程度,FP变异性和双放电的存在。单纤维针电极可以增加更多的估计值,包括运动单位纤维的密度,抖动程度和运动单位神经发芽(sprouting)的新近度。已经进行了一些成功的尝试,以使用NEMG进一步评估ALS的自然史。但是,由于其主要缺点是患者不舒服和痛苦,因此倾向于避免进行连续研究。此外,由于无法在连续的情况下重现针的位置,因此针电极作为一种监测方法受到了限制。高密度表面肌电图(HD-sEMG)是另一种非侵入性方法,可以丰富肌萎缩性侧索硬化症中有效的生物标志物的检测手段。
本篇文章将探讨高密度表面肌电技术在肌萎缩性侧索硬化症的诊断,预后,监测和病理学解决方面的显着优势。
亮点
• 高密度表面肌电图在ALS患者中比侵入性方法具有明显的实用优势。
• 存在多种技术可利用高密度表面肌电的出色空间分辨率。
• 需要跨学科的合作来应对分析和技术挑战。
目的
肌萎缩性侧索硬化症(ALS)是一种成人发作的神经退行性疾病,导致无情的运动能力下降和症状发作后的中位生存期为三年。表面肌电图代表了重大的技术进步,已被利用在新型神经生理生物标志物的开发中。我们已经系统地审查了表面肌电图技术在ALS中的当前应用。
方法
我们搜索 PubMed 以确定42项专注于表面肌电图及其相关分析方法在ALS患者的诊断,预后和监测中的研究。
结果
确定了各种各样的分析技术,包括高密度网格中的运动单位分解,运动单位数量估计以及神经元过度兴奋性或神经肌肉结构的测量。一些研究提出了具体的诊断和预后标准,但是目前缺乏大型ALS队列的临床校准。监测疾病最有效的方法是运动单位指数(MUNIX),已在两项ALS临床试验中将其作为结果指标。
结论
由于其非侵入性的性质,高密度表面肌电图(HD-sEMG)最引人注目的优势之一是它在收集纵向数据方面的实用多功能性。为了捕捉肌萎缩性侧索硬化症(ALS)中无情的神经元死亡所带来的神经肌肉结构的动态变化,有必要对相同的肌肉进行持续数月至数年的频繁评估。在没有电刺激的情况下使用表面 EMG 的技术,例如运动单元分解和 SPiQE,理论上可以应用于在没有临床医生或技术人员的情况下收集的数据,为在患者家中进行远程测试铺平道路。这可以显着增加数据收集的强度(例如每周评估),产生目前无法通过基于医院的技术获得的大量数据,并且可以使用强大的机器学习方法深度研究。我们建议未来的研究集中在能够利用表面肌电图这一主要优势的电子硬件和自动化分析工具的多学科开发上。
运动单位指数(MUNIX )已被认可为引入肌萎缩性侧索硬化症(ALS)临床试验的有价值的结果衡量标准。尽管有些人认为这不是对运动单位数的真实估计,但这不应阻止将运动单位指数作为一种经过充分验证的生物标志物检测手段,该生物标志物不仅在多个纵向队列中证明了临床相关性,而且在整个多个站点和用户。它从理论到临床验证的转换过程漫长且充满挑战,但运动单位指数引领潮流,距其推出已有 15 年。它是一个有价值的生物标志物研究成果,应该鼓励和指导那些希望在未来临床试验中塑造肌萎缩性侧索硬化症患者神经生理学评估的人。
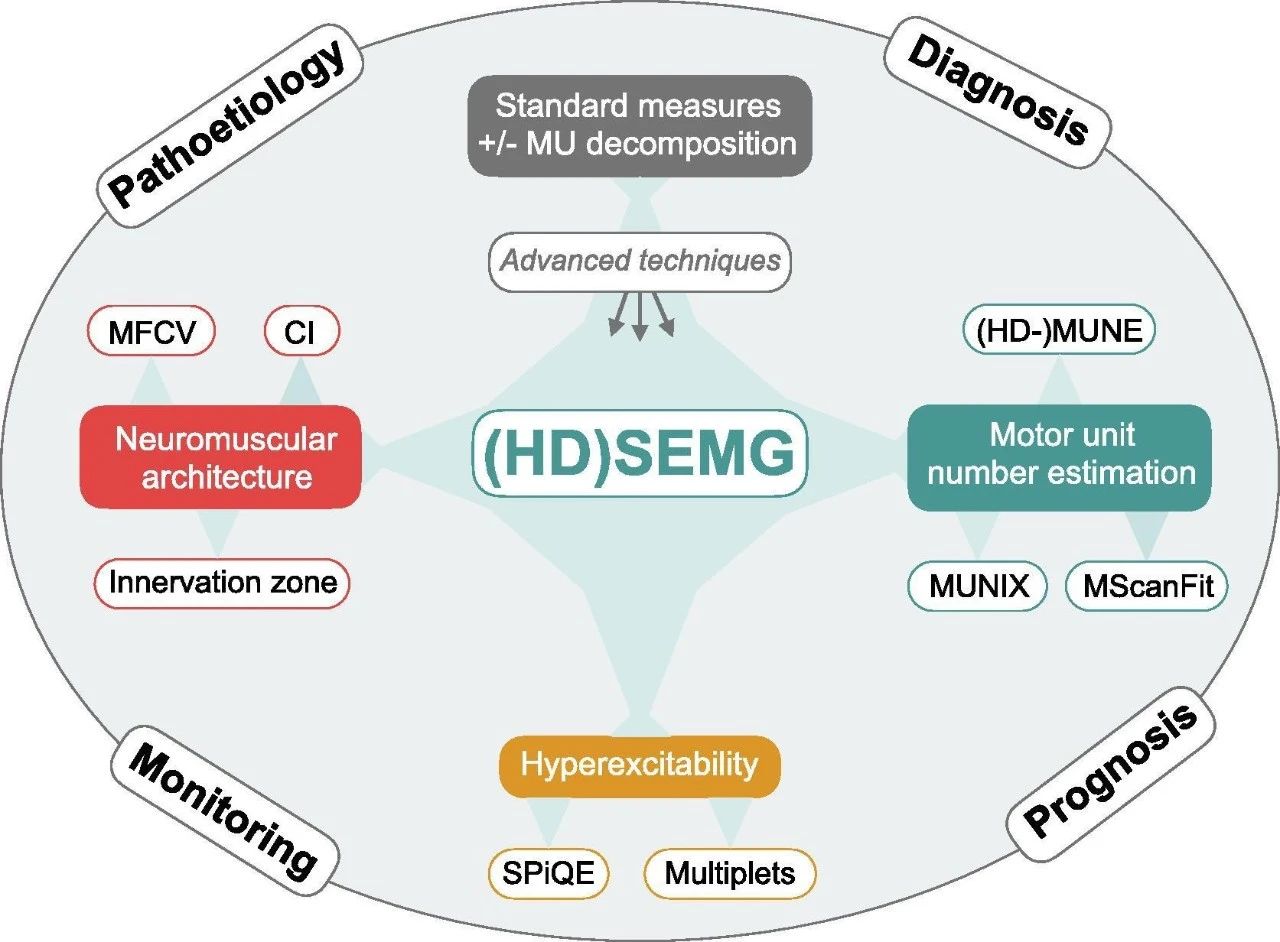
肌萎缩性侧索硬化症(ALS)中的高密度表面肌电(HD-sEMG)技术范围

1、标准高密度肌电(HD-sEMG)记录
与 针肌电图类似,SEMG 提供了 MUAP 幅度(Milner-Brown 等人,1974 年)、MUAP 持续时间(Hallett,1979 年)、MUAP 变异性和形态学(Drost 等人,2007 年)、束颤电位(FPs)频率(de Carvalho 等人,2016 年;Bashford 等人,2019 年)以及检测少量束颤电位(FPs)所需的持续时间(Zhou 等人,2012 年)。最大复合肌肉动作电位 (CMAP) 幅度很容易被单通道 sEMG 捕获,但其作为疾病生物标志物的效用受到了限制。这主要是由于 MU 神经再生的稳定效应,导致在 ALS 早期阶段最大 CMAP 幅度的变化最小(Maathuis 等,2013)。最近,正中神经和尺神经的低频重复神经刺激导致 CMAP 下降已在 ALS 中得到证实(Mori et al., 2016; Zhang et al., 2019)。
高密度表面肌电图 (HD-sEMG) 在固定网格结构中包含多个通道,旨在并行记录。 HD-sEMG 数据可通过自动检测和数据处理从一次记录中分解和分类单个 MUAP(Jahanmiri-Nezhad 等人,2014d,Jahanmiri-Nezhad 等人,2014a,Jahanmiri-Nezhad 等人,2014b,Chen和周,2016)。这一增强功能依赖于HD-sEMG可实现的改进空间分辨率,而NEMG或单通道sEMG无法实现这一点。这也提供了设计聚类指数(以及两个相关措施)的方法,该指数旨在区分ALS患者和健康对照者的自发 MUAP 放电模式(Zhang et al.,2014)。
2、运动单位数量估计 (MUNE)
最初的 MUNE 方法在 1971 年被描述(McComas 等人,1971)。它基于增量电刺激来检测记录的 CMAP 中的量子跳跃。假设每次跳跃都代表一个新运动单位的募集。然后可以将超最大复合肌肉动作电位(CMAP)除以每次量子跳跃的 CMAP 平均增加量,以计算 MUNE。这种原始方法导致了各种改进的技术,例如多点增量 MUNE (Shefner et al., 2011) 和触发平均技术 (Shahani et al., 1995),这些技术已在其他地方得到广泛评论 (Gooch等人,2014 年;de Carvalho 等人,2018 年)。 MUNE 已通过使用 HD-sEMG 进行了调整,因为无需增量或多点刺激即可平均单个 MUAP 的幅度(Boekestein 等人,2012;van Dijk 等人,2010)。
3、运动单位数量指数 (MUNIX) 和运动单位大小指数(MUSIX)
MUNIX 是 MUNE 方法的一种变体,但不是提供运动单位绝对数量的估计,而是计算运动单位数量指数(Nandedkar 等人,2004 年,Nandedkar 等人,2010 年,Neuwirth 等人) ., 2010, Neuwirth 等人, 2015)。这是一个相对值,可以在同一个人内连续比较。更高的 MUNIX 意味着更多数量的可行运动单位,但有些人认为 MUNIX 不是对运动单位数量的真实估计,过于依赖最大 CMAP 幅度(Bostock 等人,2019;Nandedkar 等人,2019 )。 MUSIX 提供了对平均运动单元大小/幅度的度量(Nandedkar 等人,2010)。与使用 HD-sEMG 计算 MUNE 不同,获取 MUNIX/MUSIX 需要大量患者合作,因为需要在整个范围内进行分级肌肉收缩。 MUNIX 每块肌肉需要 3-5 分钟才能产生结果(Nandedkar 等人,2004 年),据报道,它具有良好的可重复性(Neuwirth 等人,2010 年;Fathi 等人,2016 年)。多个中心的健康对照和 ALS 患者的 MUNIX 操作者测量值之间具有良好的相关性(Nandedkar 等人,2011;Ahn 等人,2010)。 MUNIX 评估的最新指南强调应花更多时间优化记录电极的放置,否则可能会低估(Nandedkar 等人,2018 年)。
最近,MUNIX 的重测信度在欧洲和北美 27 个中心的 36 名评估者中进行了评估,然后将其作为一项自然历史研究的结果测量(Biogen,协议 999AS003,ClinicalTrials.gov 标识符: NCT02611674)和 ALS 中的一项药物试验(Biogen,协议 233AS101,ClinicalTrials.gov 标识符:NCT02623699)(Neuwirth 等人,2018)。为了获得资格,每位评估者在两次评估 24 块肌肉时必须证明变异系数 (COV) < 20%。平均(±标准偏差)COV 为 12.9% (±13.5)。这项研究是在广泛的地理区域实施和标准化经过验证的神经生理学生物标志物的道路上的一项显着成就。
4、MScanFit(复合肌肉动作电位扫描,CMAP 扫描)
与计算量大的贝叶斯统计方法(Ridall et al., 2006)相关,MScanFit 是一种更实用的运动单位数估计方法。 它基于在从亚阈值到超最大值(CMAP 扫描)的增量刺激强度下采集多个 CMAP(Bostock,2016 年)。 MScanFit 模型比最大 CMAP 幅度本身提供的信息要多得多,它考虑了活动运动单元的完整补充,从而减少了更传统的运动单位数目估计(MUNE)方法可能存在的采样偏差。 MScanFit 报告了 ALS 患者的拇短展肌在评估者间和评估者之间具有出色的变异性,并且每块肌肉只需 6 分钟多一点就能产生结果(Jacobsen 等人,2017 年)。
此方法使用的CMAP扫描是非侵入性的,并且通过自动分析快速执行,因此,在临床应用中具有巨大的潜在应用前景。
5、Surface Potential Quantification Engine(SPiQE),表面电位量化引擎
这是一种自动分析方法,通过HD-sEMG用于记录的肌束颤动表征(Bashford 等人,2019;Bashford 等人,2020)。它的设计依赖于噪声响应算法,该算法连续检测实时采集噪声水平,并相应地调整震颤的振幅包含标准。这被证明在从原始 HD-sEMG 数据中识别肌束时达到了 88% 的良好分类准确度。
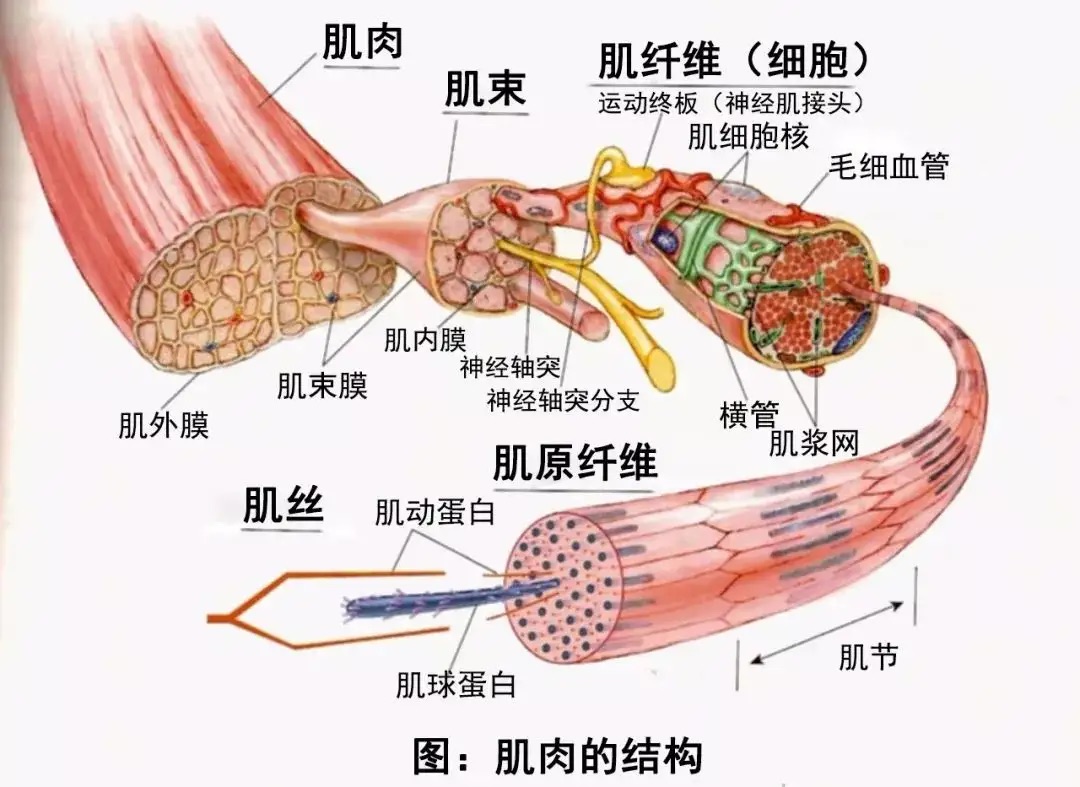
肌纤维是由许多肌纤维构成的,肌纤维就是由许多肌丝构成的。在肌肉收缩时,肌丝是收缩的部分。肌肉纤维由两种主要成分组成:肌球蛋白(短丝)、肌动素(长丝)和肌动素。另外两个重要的蛋白质是肌钙蛋白和肌球蛋白。肌束是由50~150根肌纤维聚集而成,外包的结缔组织膜则是肌束。这是肌肉的组成部分。
6、多重发放电位 (Multiplet discharge, MD) 检测
一些研究使用 HD-sEMG 检测 ALS 患者近端电刺激后的 MD(Sleutjes 等人,2015a,b,Maathuis 等人,2012)。在每个站点,校准刺激以激活 5-6 个运动单位。 MD(双峰、三峰或四峰)被定义为一系列相同的运动单元动作电位(MUAP),峰间间隔<30 ms。 HD-sEMG 卓越的空间分辨率允许将 MD 准确表征为双联体、三联体或四联体。
7、神经支配区 (IZ) 分析
HD-sEMG 能够提供有关供应单个肌肉的运动单位神经支配区的结构信息(Mesin 等人,2009;Buchthal 等人,1955;Guzman 等人,2011)。 运动单位神经支配区长度定义为一个运动单位中最远端和近端神经肌肉接头(由 HD-sEMG 检测)之间的距离。 据推测,随着 ALS 中的下运动神经元死亡,并且存活的运动单位随后进行神经再支配,IZ 特征可能会发生变化,因此提供了该疾病的有用的生物标志物(Jahanmiri-Nezhad 等,2015)。
神经支配的区域,是被支配的器官就称为该神经的终末器官。神经支配大致可区分为传出性的和传入性的,前者有支配肌肉的运动神经和支配腺神经支配体的分泌神经,后者是从感受器传至中枢的感觉神经,神经支配的区域遍布全身。
意义
与侵入性技术相比,高密度表面肌电(HD-sEMG)技术可以充实肌萎缩性侧索硬化症有效生物标志物的检测手段。
便携式高密度肌电测试系统

高密度肌电测试系统由 64 通道(最大支持256通道)无线高密度肌电信号采集系统以及专用分析软件组成。能进行肌电信号采集,具备在运动条件下测量数据的能力,具有良好的兼容性与扩展性且支持离线采集。该系统可广泛应用于人机交互、脑机接口、虚拟现实、智能假肢、康复医疗以及运动训练等领域。
丰富的配件

分布式多通道常规肌电图,每组4、8、16通道传感器(最大256通道)

32/64 通道 4 x 8 /8 x 8 HD-EMG 网格可以根据客户需求定制不同的电极间距电极片(8mm / 10mm / ...)传感器

分散式高密度肌电,每组4、8、16通道传感器(最大256通道)
可重复使用8 通道高密度织物肌电传感器(支持定制)

可拉伸柔性高密度肌电电极(32/64 通道 4 x 8 /8 x 8 HD-EMG)
高密度肌电采集分析软件
主要优势:
1、多模态数据同步模块,可实现多种信号实时同步传输;
2、可配置设备的采集参数,实现数据同步采集功能,可显示实时波形、实时频谱图、实时电势图和3D模型姿态;
3、自定义动作序列播放功能,并用Mark点标记动作事件信息;
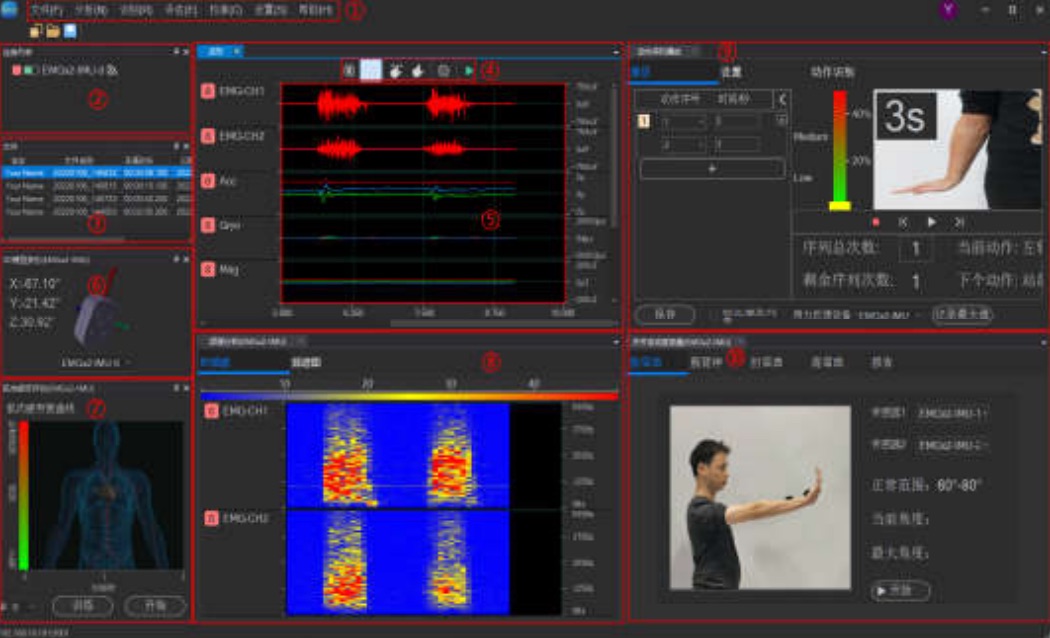
软件操作界面
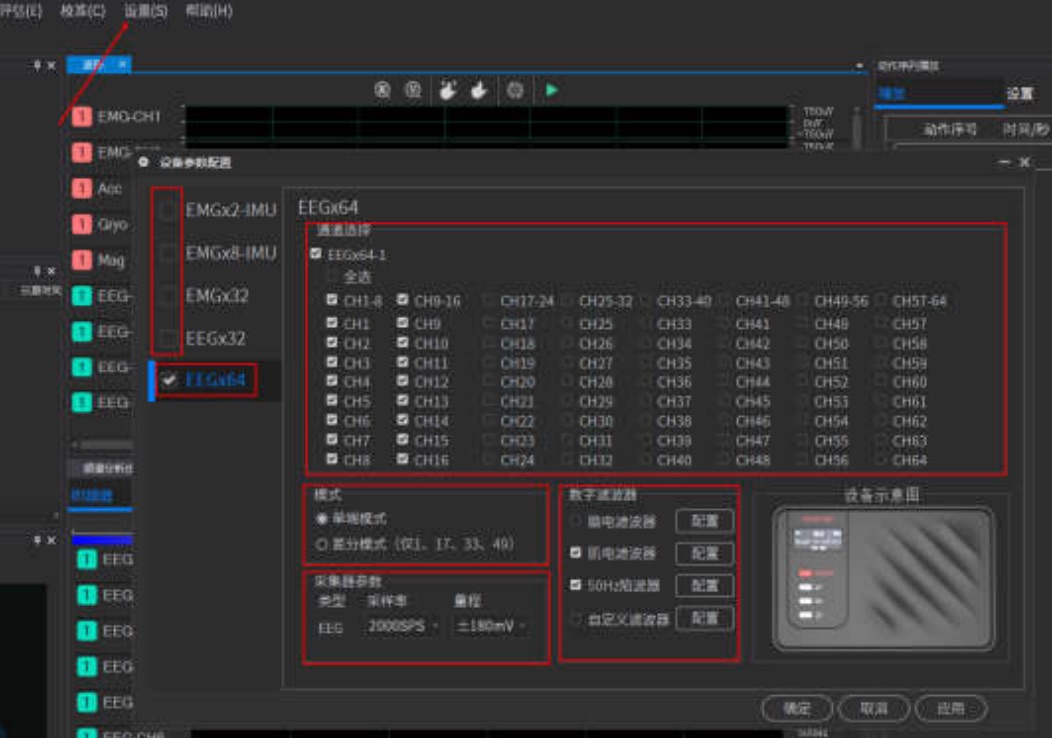
支持肌电、心电、脑电、惯性信号、血氧、血压的多种信号联合采集,并配置设备采集参数
实时显示设备的连接状态、电量和信号强度
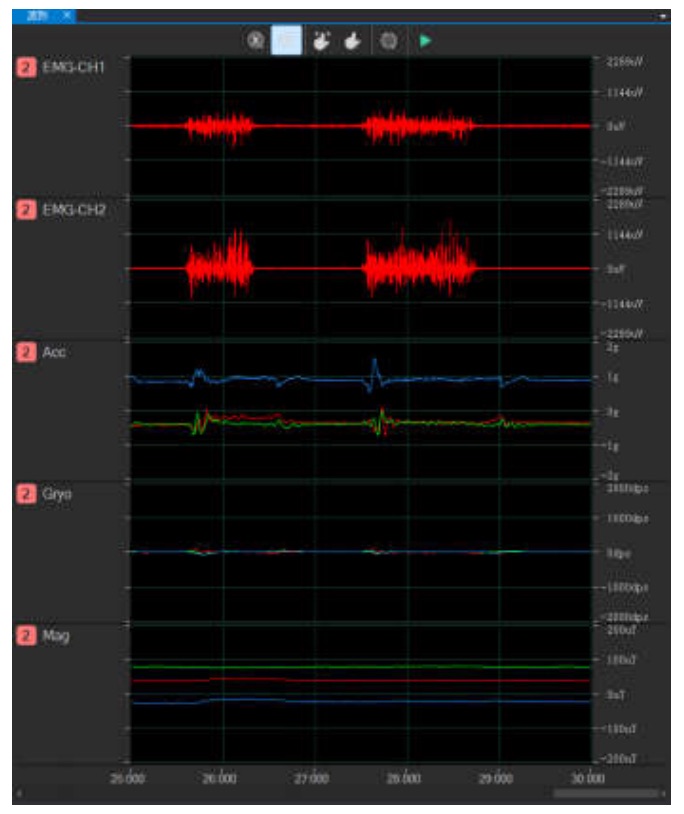
实时显示波形
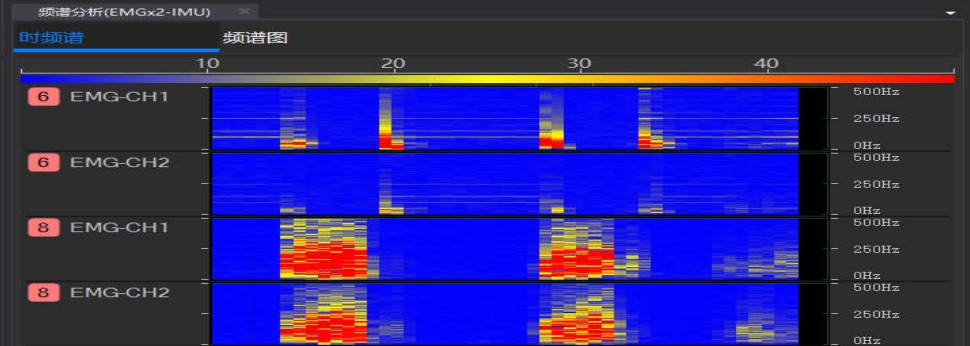
实时频谱图、时域频谱
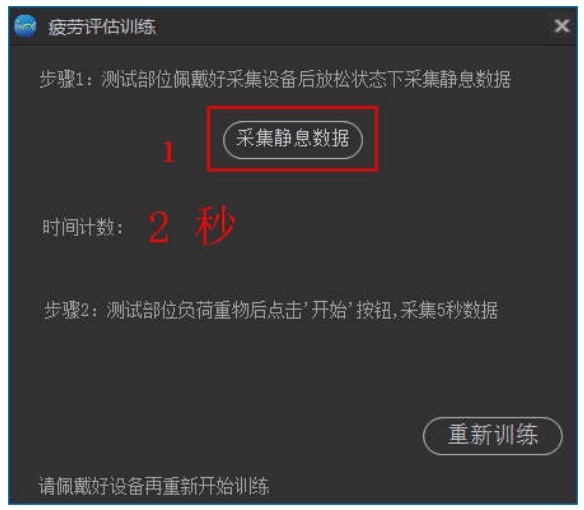
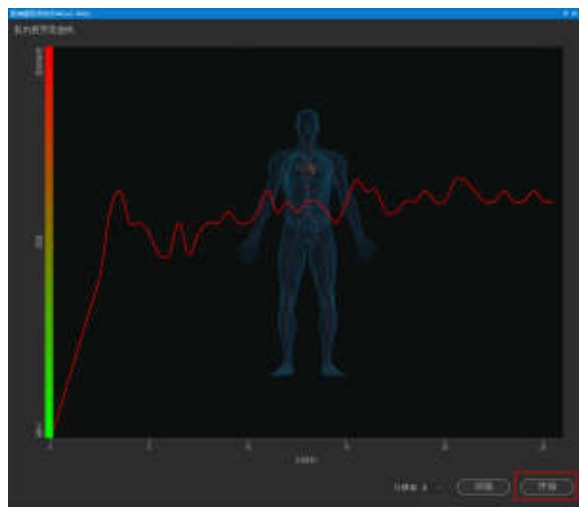
肌肉疲劳分析
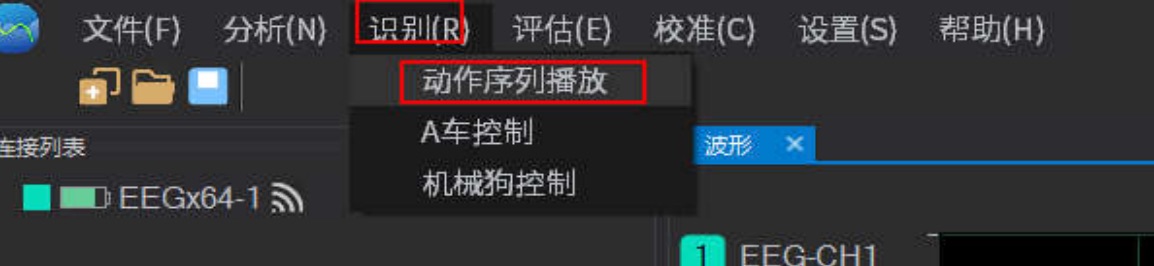

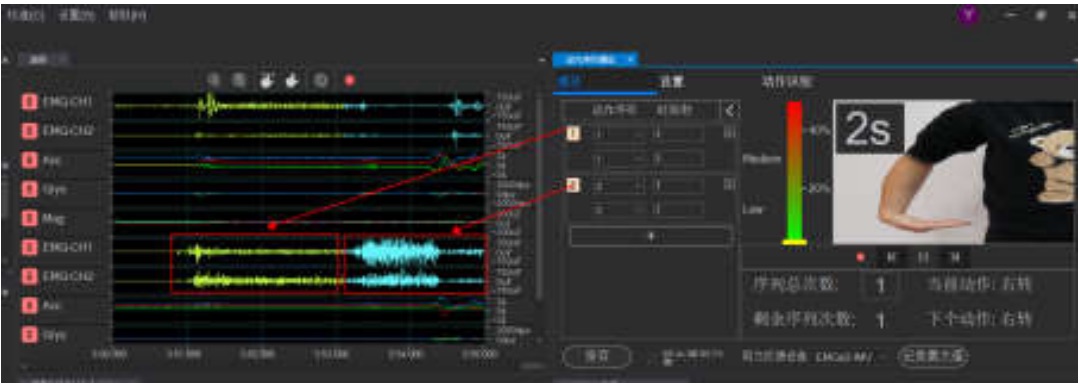
自定义动作序列播放功能,并用Mark点标记动作事件信息,不同动作序列用不同颜色表示
如果您对高密度表面肌电感兴趣,请与我们联系!
声明:文章仅用于学术交流,不用于商业行为,若有侵权及疑问,请后台留言,管理员即时删侵!
